肥胖是一种全球性的流行病,会导致糖尿病、心血管疾病、脂肪性肝等多种代谢并发症。白色脂肪组织的慢性炎症是肥胖和相关代谢综合征之间的关键环节。TRPM7与炎症有关,但其在肥胖脂肪细胞表型和功能中的作用尚不清楚。2023年1月30日,中山大学附属第六医院高旻、黎小妍团队在Nature Communications IF=17.694 发表了题为:Adipose-specific deletion of the cation channel TRPM7 inhibits TAK1 kinase-dependent inflammation and obesity in male mice 的研究论文,发现脂肪细胞TRPM7的激活在促炎反应中起着重要作用,TRPM7引发的Ca2+内流通过CaMKII和TRAF6的共同调节增强了TAK1激活,增强了NF-κB信号通路,导致促炎表型和高脂饮食小鼠的体重增加。
· 维真助力:AAV载体 ·
实验动物
TRPM7fl/fl雄性成年小鼠
TRPM7敲除雄性成年小鼠(ATKO)
病毒产品
AAV8-TAK1;AAV8-Vec;
AAV8-Adipoq-Cre
注射总量
每次5μL,共8次
(1×10E13 viral genome copies)
注射部位
附睾脂肪组织

01 结果展示
1. 脂肪细胞特异性TRPM7缺乏可减轻HDF引起的肥胖
作者发现与对照组相比,HFD诱导eWAT(内脏附睾白色脂肪组织)和iWAT(腹股沟皮下白色脂肪组织)中TRPM7 mRNA和蛋白质水平显著升高,为了评估脂肪细胞特异性TRPM7的作用,作者将TRPM7fl/fl小鼠与Adipoq-Cre小鼠杂交,生成脂肪特异性TRPM7敲除小鼠(ATKO),16周后, 喂食高热量食物的ATKO小鼠体重增加较少,而且比对照组更瘦,显微图像显示,ATKO小鼠脂肪组织脂肪质量急剧下降,同时甘油三酯(TG)和游离脂肪酸(FFA)显著下调。ATKO小鼠的耗氧量、二氧化碳产量和能量消耗率增加,此外,ATKO小鼠体重减轻与食物摄入量的变化无关,这表明脂肪细胞特异性TRPM7敲除小鼠对饮食诱导的肥胖的抵抗归因于更高的分解代谢率。
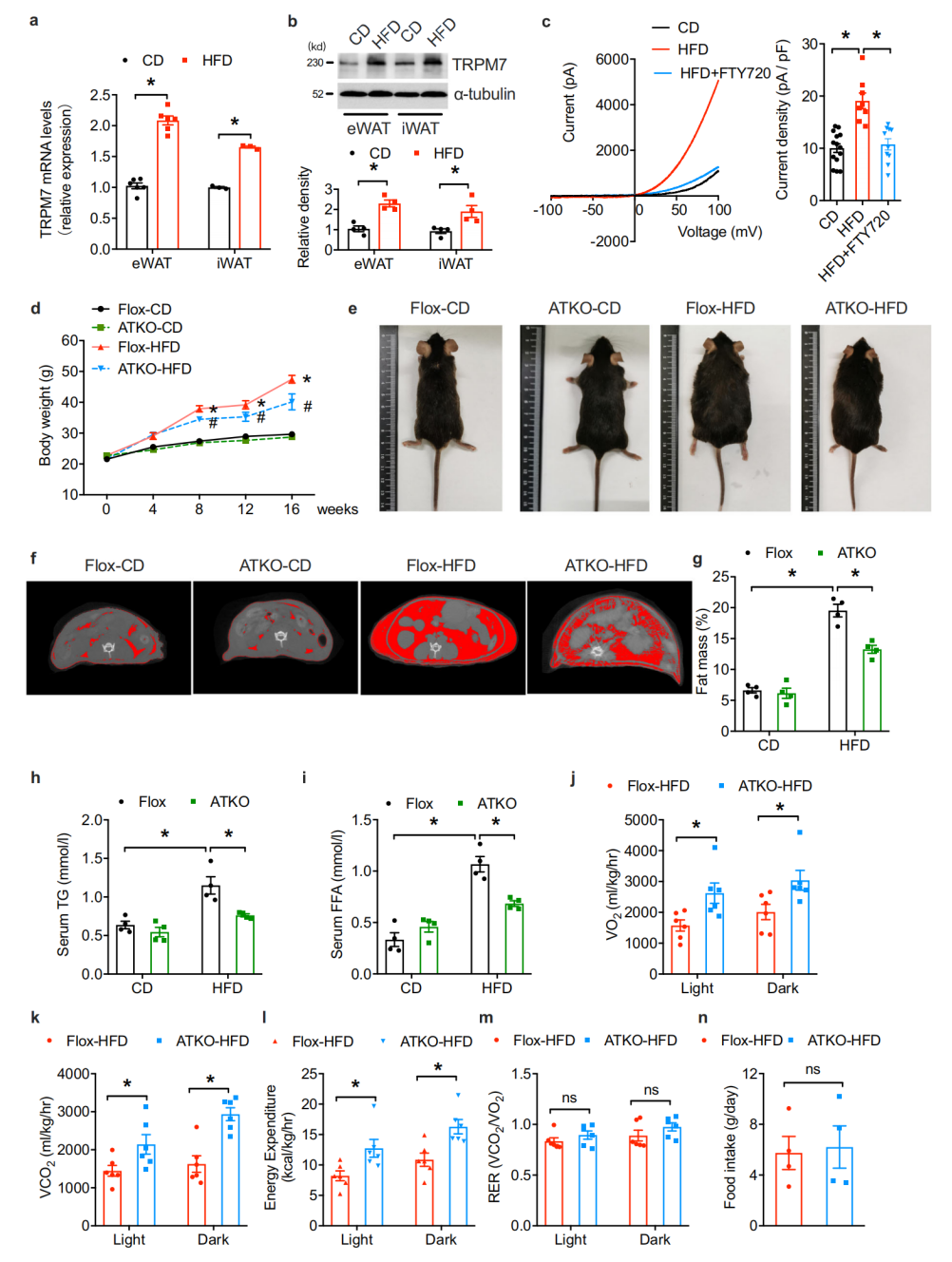
图1. TRPM7缺乏可减轻HDF引起的肥胖
2. TRPM7敲除减轻高热量饮食引起的脂肪炎症
RNA-seq结果发现,HFD喂养ATKO小鼠炎症相关基因(MCP-1、IL6、IL1β、IL18、TNF-α)下调。由于由HFD激活的IKKβ/NF-κB信号通路是炎症基因诱导所必需的,作者检测了HFD喂养的ATKO小鼠中该通路的完整性,TRPM7的敲除显著降低TNF-α激活的IKKβ和NF-κB p65的磷酸化以及IκBα的降解。
肥胖可将脂肪组织免疫细胞从抗炎状态调节为促炎状态。为了确保实验结果不受TRPM7敲除小鼠体重减轻的影响,作者在不影响全身体重的条件下利用AAV对脂肪细胞TRPM7进行了急性删除。注射AAV后4周,处死小鼠并进行组织分析发现TRPM7 mRNA的表达水平在分离的脂肪细胞中显著降低,且实验组和对照组体重水平无变化。与对照组相比,脂肪细胞TRPM7的急性缺失导致eWAT中巨噬细胞浸润减少,炎症标记基因表达降低和NF-κB信号活性降低。表明,脂肪细胞特异性TRPM7缺失减少了脂肪组织中促炎细胞因子的分泌,抑制了促炎巨噬细胞的浸润,导致炎症反应减弱。
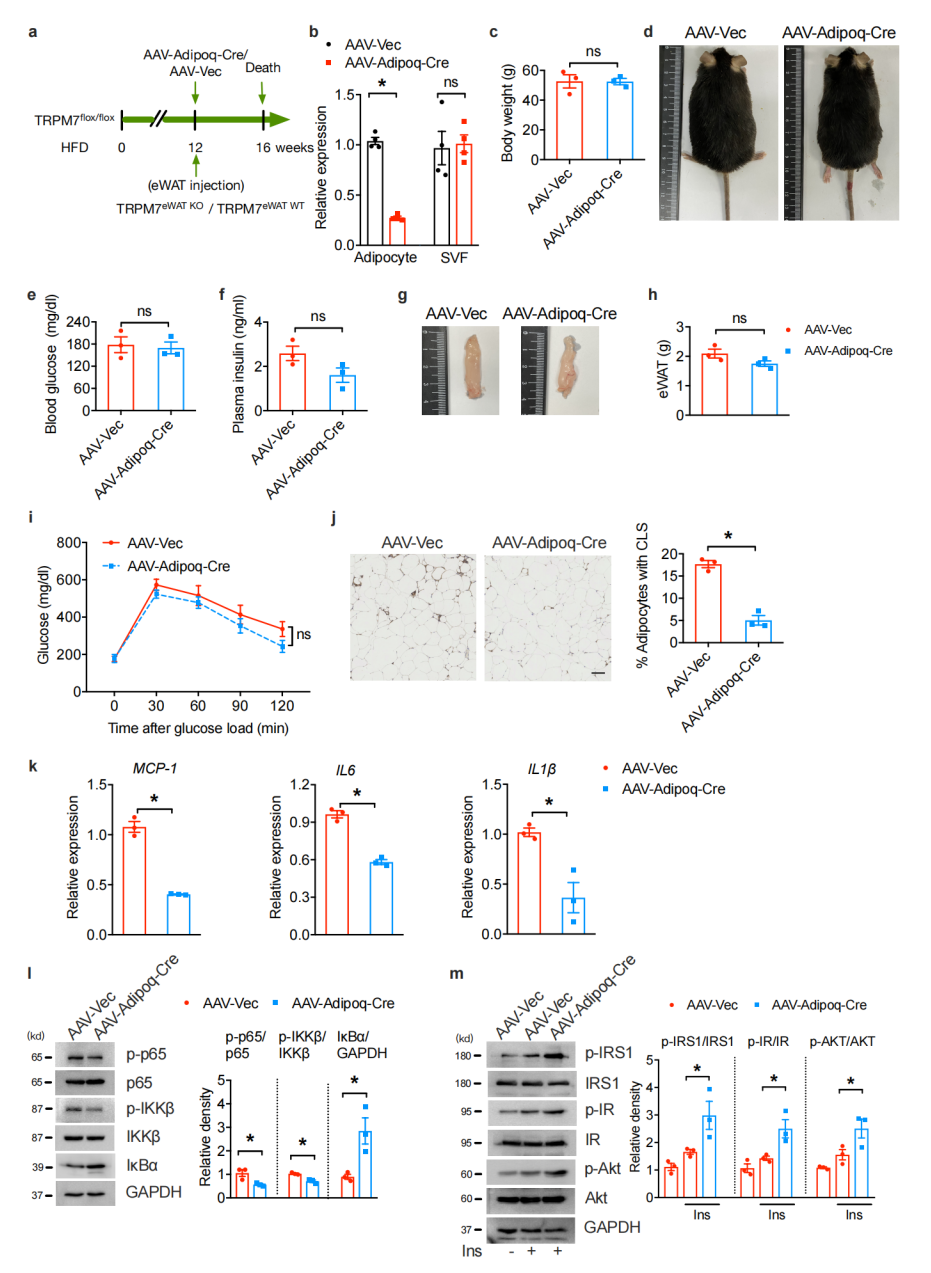
图2. TRPM7缺乏可减轻脂肪炎症,但与体重减轻无关
3. TRPM7介导的脂肪细胞炎症依赖于TAK1的激活
作者发现,TRPM7通过Ca2+信号调控NF-κB信号通路。TAK1是NF-κB信号转导的重要上游因子,可诱导NF-κB活化。HFD显著增加了TAK1 Thr 187的磷酸化,TRPM7的缺乏消除了HFD促进TAK1在eWAT中的激活。作者探索了TRPM7介导的Ca2+信号与TAK1激活之间的潜在联系。CaMKII(钙/钙调蛋白依赖性蛋白激酶II)由Ca2+流入激活,是TAK1的上游因子,能直接结合并磷酸化TAK1,CaMKII过表达逆转了TNF-α治疗时TRPM7敲除对TAK1抑制。同时CaMKII抑制剂KN93抑制了TNF-α诱导的TAK1磷酸化,但与TRPM7的抑制相比,抑制水平是不完全的,CaMKII直接但部分地促进了TRPM7依赖的TAK1磷酸化,表明除了CaMKII激活外,TAK1的激活还涉及其他机制。
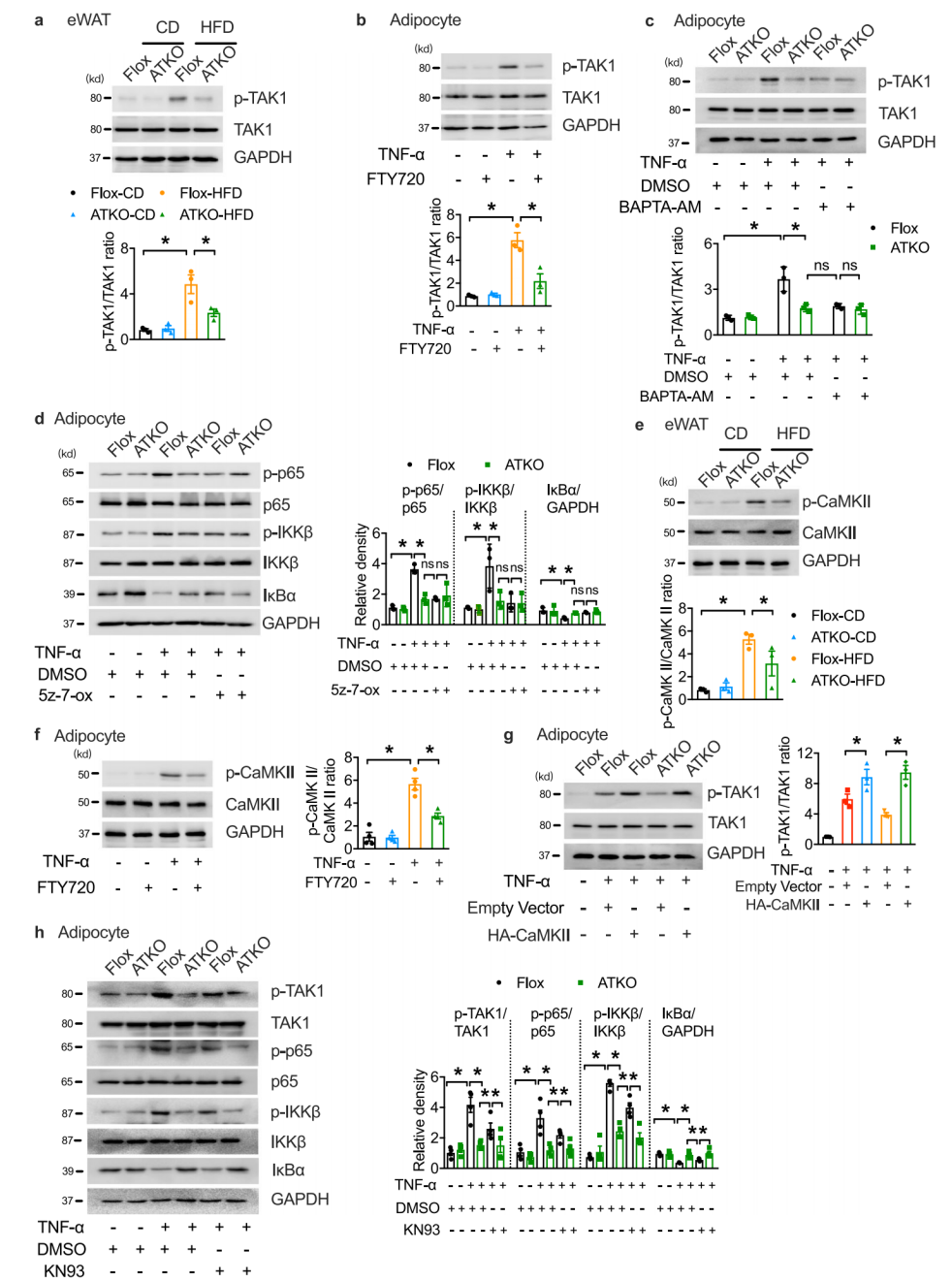
图3. TRPM7通过激活TAK1促进NF-κB信号,部分依赖于CaMKII
4. TRPM7激活TAK1磷酸化需要CaMKII和TRAF6
研究表明,HFD通过TAK1多泛素化和随后的磷酸化导致TAK1过度激活。在TNF-α刺激培养的原代脂肪细胞中,TRPM7消耗可以减少TAK1的泛素化。为了研究泛素化修饰的作用,作者筛选了几种已报道的影响TAK1泛素化E3连接酶,发现TRPM7过表达后,只有TRAF6介导的TAK1泛素化显著增强,TRAF6的沉默显著降低了TAK1的泛素化,进一步研究表明,TRAF6通过K63激活TAK1。基因沉默实验发现CaMKII或TRAF6基因的单独沉默只导致脂肪细胞胰岛素敏感性的部分改善,而这两个基因的共同沉默强烈地恢复了胰岛素信号转导。这些观察结果表明,CaMKII和TRAF6的作用不同,但共同促进TRPM7介导的TAK1激活和脂肪细胞炎症。
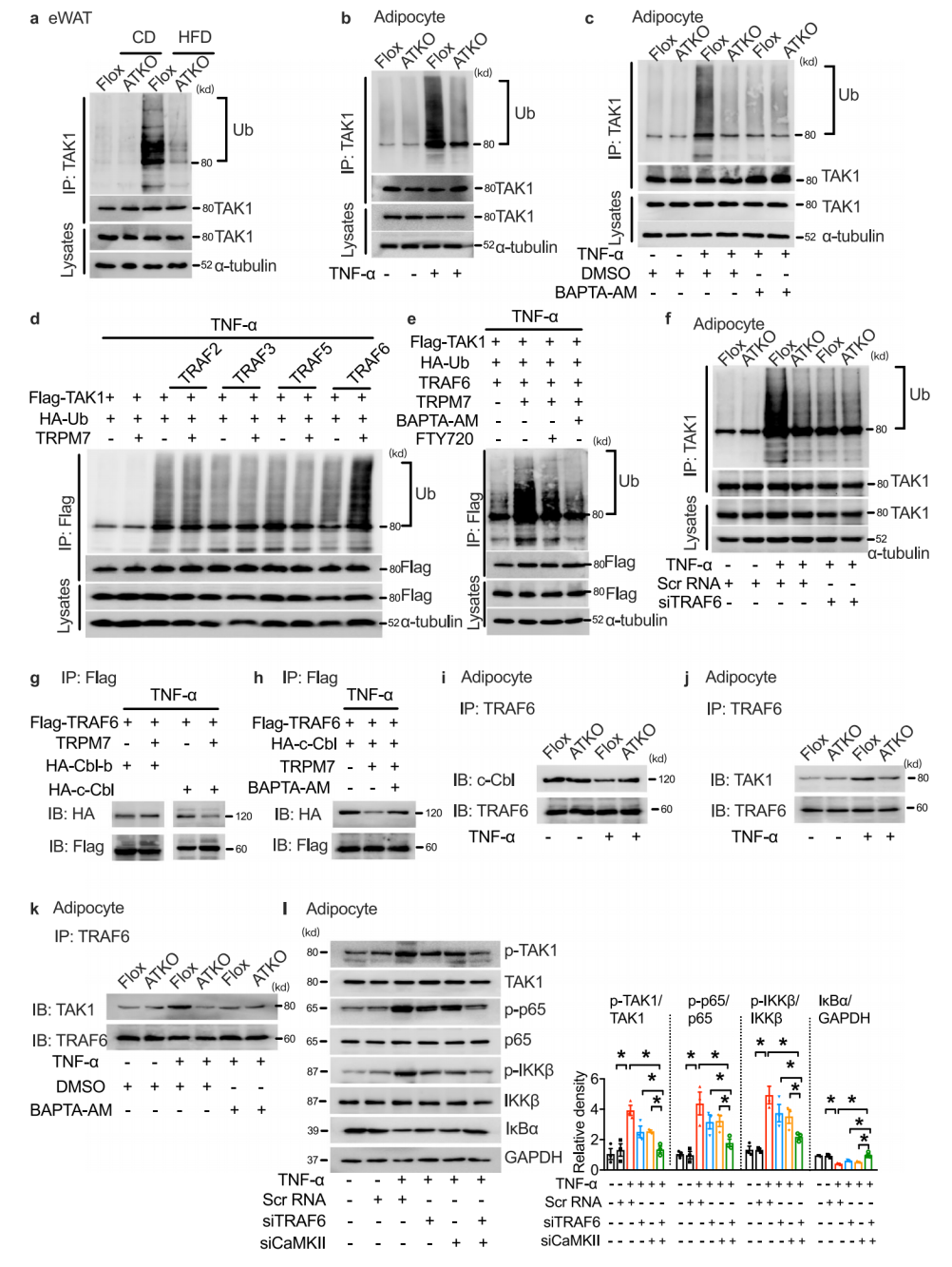
图4. TRPM7激活TAK1磷酸化需要CaMKII和TRAF6
5. HFD条件下过表达TAK1可以促进脂肪炎症
为了研究TAK1在体内对TRPM7介导的脂肪炎症的影响,作者使用AAV在eWAT中持续表达全长TAK1。16周的HFD后,实验组和对照组ATKO小鼠的体重没有差异,表明HFD喂养下,局部增加TAK1表达可能不足以挽救ATKO小鼠全身葡萄糖稳态障碍。基因表达分析发现,脂肪组织促炎标志物(MCP-1, IL6, and IL1β)在ATKO小鼠中因TAK1过表达而显著增加,并伴有NF-κβ级联激活的恢复。
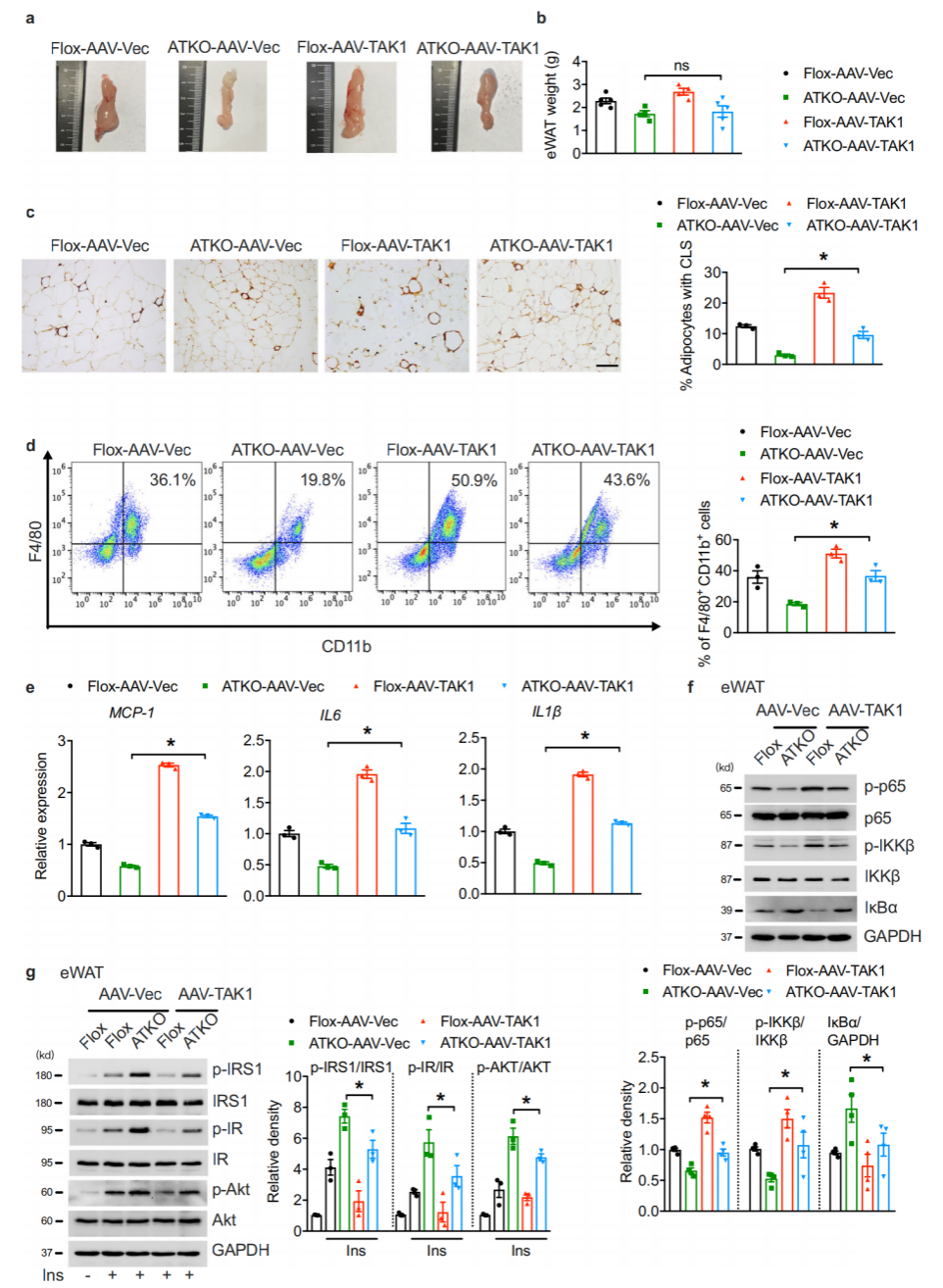
图5. TAK1过表达增强TRPM7敲除小鼠的脂肪炎症
02 实验结论
研究揭示了脂肪细胞TRPM7在调节脂肪炎症和全身代谢中的作用。脂肪特异性去除TRPM7可显著减弱脂肪炎症,从而改善脂肪功能、胰岛素敏感性和葡萄糖耐量。此外,TRPM7依赖的Ca2+信号通过TAK1激活促进脂肪细胞炎症,CaMKII与TRAF6联合作用影响TAK1激活,导致NF-κB激活和炎症反应。这些见解为更好地理解脂肪炎症和TRPM7如何调节肥胖中的葡萄糖稳态开辟了一条研究路线。
