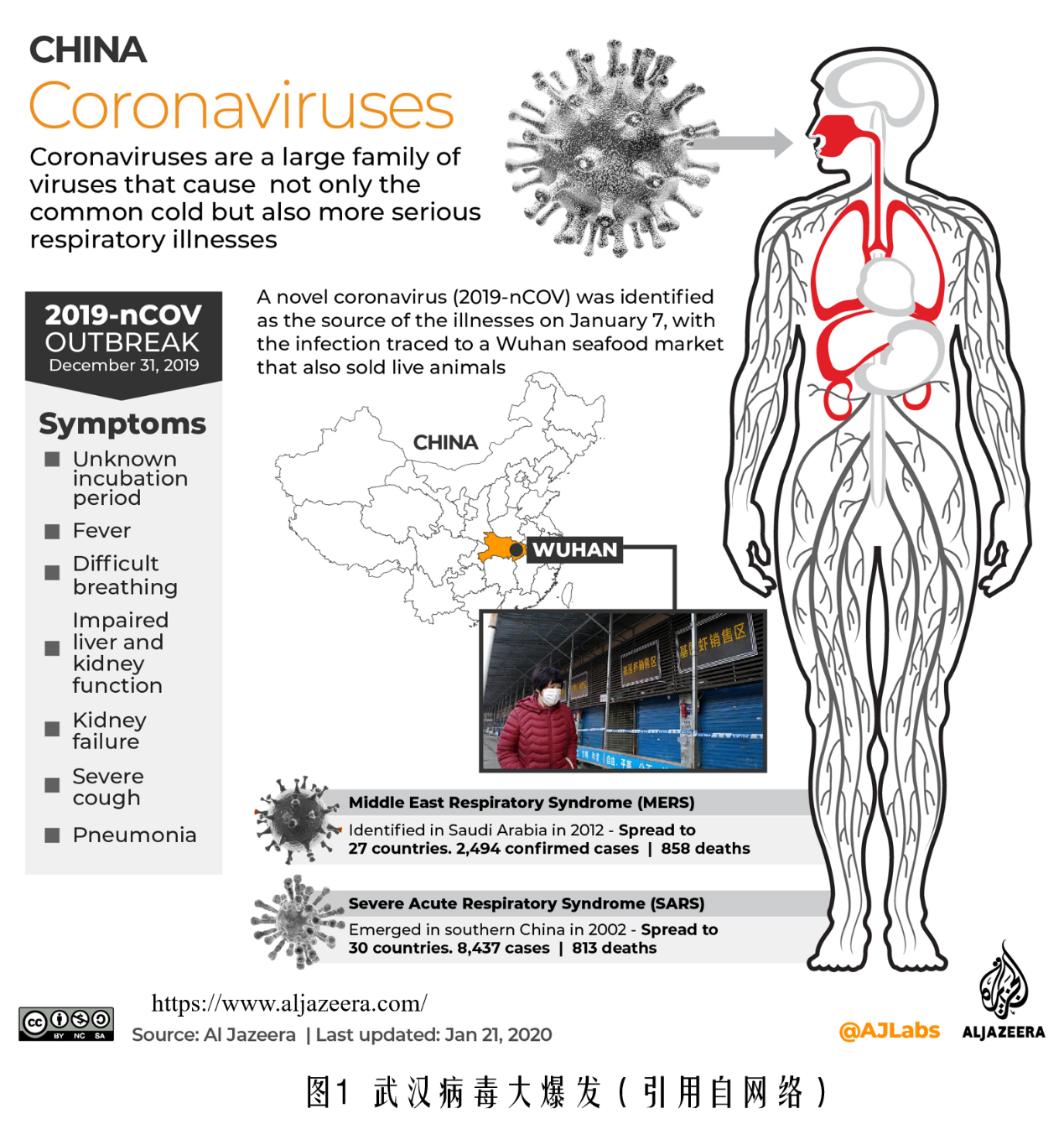
2019年年末,一场大规模的“瘟疫”从中国中部省份湖北武汉市爆发,这场由2019-nCoV引起的病毒性感染在短短一个多月内席卷神州大地,在交通日益发达的条件下,世界其他国家也纷纷“沦陷”。由于病毒可以很容易地通过飞沫进入呼吸道,使得其传播极为迅速,截止2020年2月7日17:30,中国已经有31252人确诊,26395人疑似,死亡637人,治愈1628人;海外确诊267人,死亡1人。冷冰冰的统计数字之下,是一条条鲜活的生命,破碎的家庭。该疾病会造成发热,呼吸困难,肝肾功能受损,严重**甚至肺炎,情况严重将会造成休克甚至死亡,目前的死亡率为2%。但因为疫情还没有结束,在没有开发出有效疗法或药物之前,不排除死亡率会有上升的可能。

那么,造成这场灾难的元凶病毒究竟是何方妖孽。按照生物学对生命的定义,病毒介于生命和非生命之间,只有在宿主(细胞生命体)体内才有生命活动,离开宿主则完全看不到“活物”的特征。病毒的起源众说纷纭,因为没有可以长久保持在地壳中的结构,病毒至今并没有可供研究起源的化石存在。主流的说法是病毒自生命之初便存在。病毒的大小不一,大的有长达1μm肆虐非洲的埃博拉病毒,也有只有20μm大小的犬类细小病毒(很多幼年宠物狗都死于该病毒,现在也是宠物狗必注射的疫苗之一),冠状病毒的大小只能说是位居中游。病毒的遗传物质可以是RNA也可以是DNA,可以是双链也可以是单链,可以是球形也可以是杆状。感染人类的冠状病毒外观与SARS十分接近。
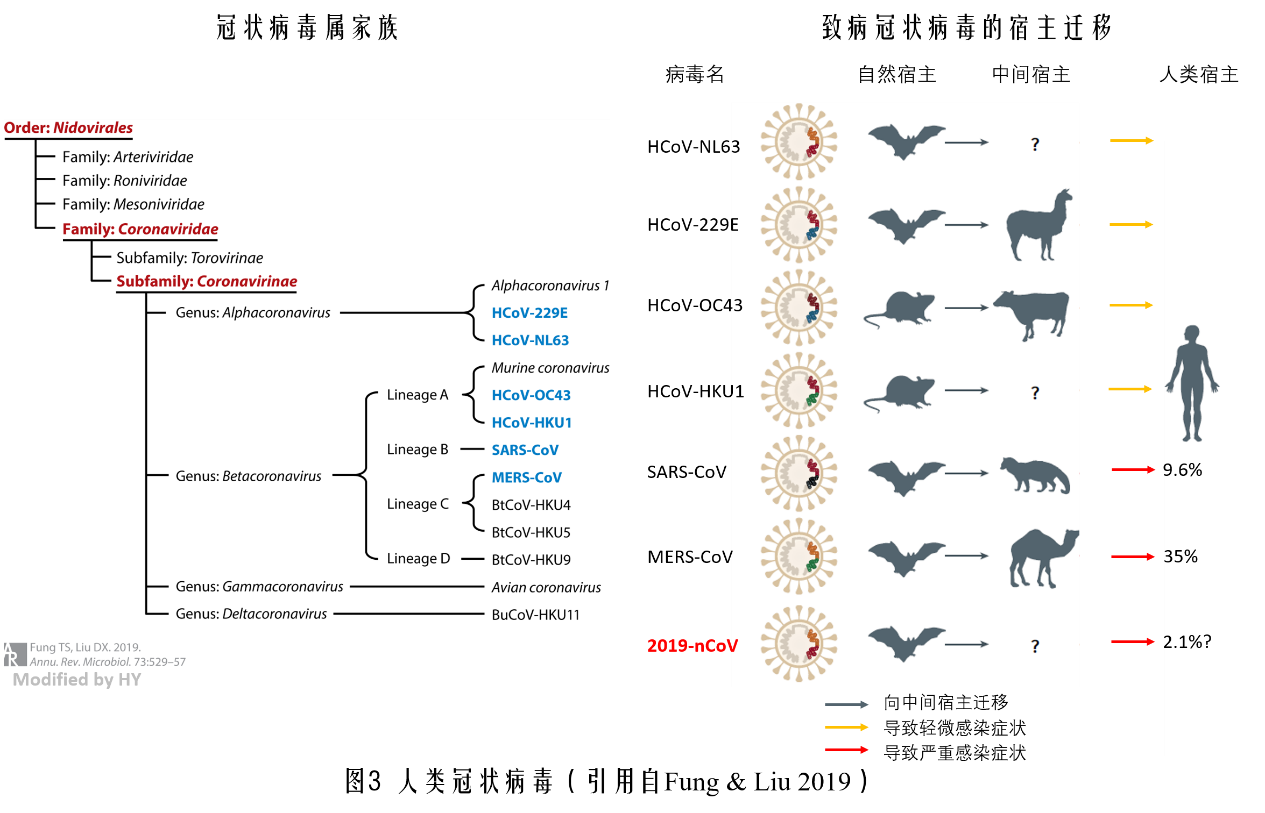
按照分类,冠状病毒属于脊椎动物的单正链RNA病毒下的套式病毒目(Nidovirales)冠状病毒科(Coronaviridae)。脊椎动物四个字说明该病毒是以脊椎动物为宿主,单正链代表其遗传物质只有一条RNA链,且该RNA可以直接利用细胞内部体系合成自身蛋白。套式病毒目下有四个科,冠状病毒科是其中之一;冠状病毒科中的冠状病毒亚科中就有臭名昭著的引起SARS(Severe Acute Respiratory Syndrome,严重急性呼吸道综合症)和MERS(Middle East Respiratory Syndrome,中东呼吸综合征)的元凶。这两种病毒又同在这个冠状病毒亚科内的β属。
武汉病毒爆发之后能够感染人的冠状病毒增加到了7种,这次的2019-nCoV病毒和SARS的亲缘关系更近,算是给SARS-CoV找了个亲兄弟。7种病毒中的4种基本已经能与人类和平地相处,只是在免疫力降低时偶尔兴风作浪,产生一些常见的感冒症状。不过由于这些病毒已经被人类的免疫系统记录在案,因此很容易被免疫细胞和抗体及时体捕获消灭,无法有更大的作为。而造成SARS和MERS这两种疾病的病毒在疫情爆发之初,免疫系统与它们俩素未谋面,只能按程序走完免疫程序的所有流程,但在这种没有准备的情况下,部分人的免疫系统要么反应太慢,要么反应过激攻击自身细胞,造成死亡。因此人类在2002年和2012年被打了个措手不及。在确诊的病例中,SARS全球确诊了8000多人,MERS确诊了2000多人,死亡率分别为9.6%和35%。
这七种病毒的自然宿主有5种是蝙蝠,两种为野生啮齿类动物。对人类有重大威胁的三种烈性病毒(SARS-CoV,MERS-CoV和2019-nCoV)目前主流认为都是来自蝙蝠体内。SARS-CoV的中间宿主暂时锁定在果子狸,而MERS-CoV则是骆驼。那么为什么病毒不能直接从蝙蝠传染到人呢,这主要是因为一来蝙蝠大多生存在与人类活动相距甚远的区域,需要有其他与人类有密切接触的动物代为传递;二来则是病毒也需要在别的物种中发生重组,才更有可能感染人类。目前2019-nCoV的中间宿主还没有确定,所以才有了因为直接食用野生动物而致病的说法。(目前中间宿主初步怀疑是穿山甲)
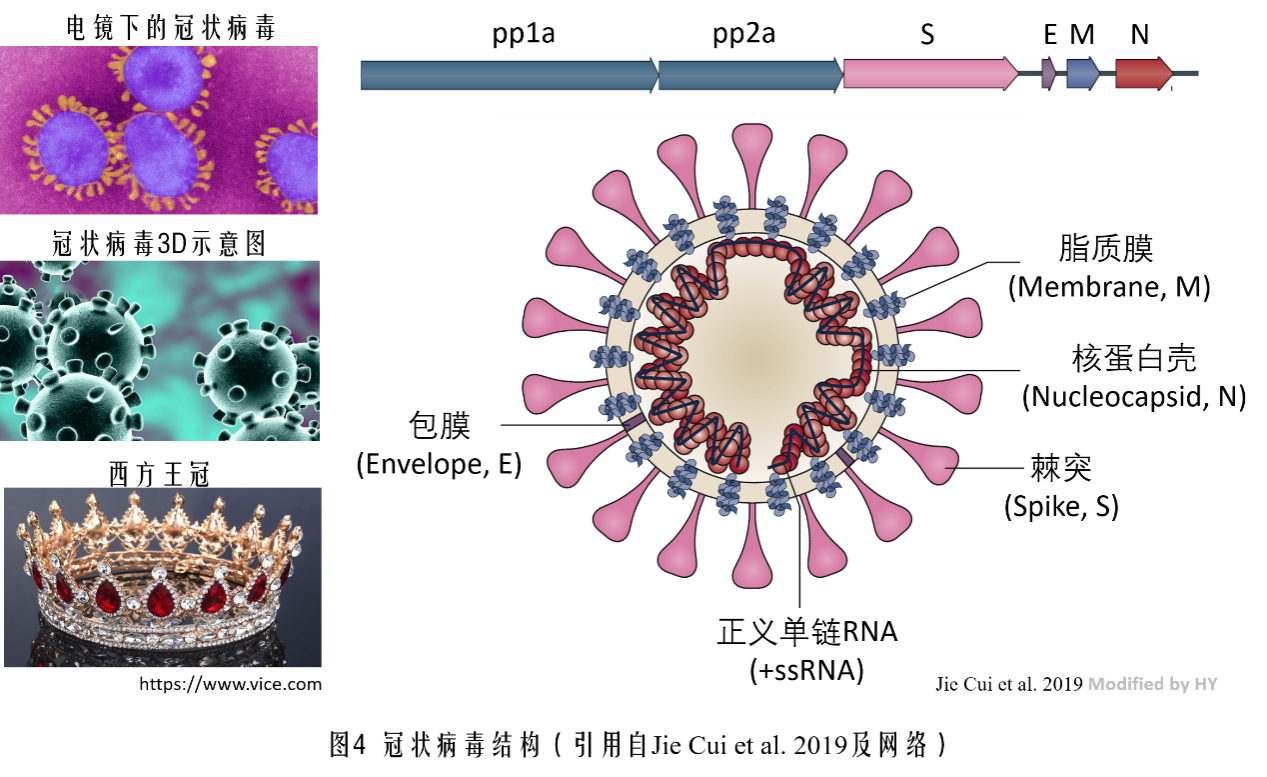
既然是冠状病毒,这个冠状的意思就是长得像王冠或者**,不过这种式样的冠在中国传统是没有的。这里的冠状指的是西方的王冠,就是将病毒拍扁了在电镜下的样子。其中最明显的特征就是和王冠边缘一样的突起,这些玩意儿就是一种叫做棘突(Spike)的糖蛋白,功能就像钥匙一样与细胞膜上的锁(膜受体)结合,打开进入细胞内部的大门,该结构由病毒基因组上的S(取Spike的首字母)基因合成;棘突连接在脂质膜上,这些脂质膜可以与细胞膜融合,方便其进入细胞,同时也起到一定的保护病毒的作用;再往下一层就是病毒的包膜(Envelope),与脂质膜不同,这层结构是蛋白组成的,也起到保护病毒的作用,为什么酒精能起到杀灭新冠状病毒的作用呢,就是因为75%酒精能使这层包膜的蛋白质发生变性,从而将病毒破坏。再往内部就是RNA以及和RNA结合维持其稳定的核蛋白了,这是病毒的核心。除了脂质膜可以利用细胞现成的 以外,其他的结构都需在细胞内合成,指导这些蛋白合成的RNA都在冠状病毒的这条RNA链上。图中pp1a和pp2a编码16个左右复制相关的酶,这两个开放阅读框的长度占到了约整个病毒RNA的2/3,其他的结构性蛋白大约占1/3。
通过对早期患者的支气管肺泡灌取液中病原物进行测序,人们已经清楚了该病毒RNA序列。通过比对分析发现该2019-nCoV的基因序列与中国菊头蝠体内的冠状病毒BatSL-CoV和2002年席卷华夏的SARS-CoV高度一致。三者病毒的RNA长度都是接近30kb的核苷酸。
从编码蛋白的RNA开放阅读框(ORF)顺序来看,复制酶编码序列,、棘突编码序列,、脂质膜编码序列,、E,、M以及后面三个阅读框的排列顺序是一致的,即都是按照PP1A-PP1B-S-3A-3B-E-M-6-7A-7B的顺序排列;7B之后的ORF顺序则是新冠状病毒与BatSL-CoV更接近。总之,目前发现2019-nCoV与蝙蝠的一种冠状病毒基因组的相似性达到了96.2%,而与SARS病毒的相似性为79.5%,即便如此,SARS病毒也是能感染人的病毒中和2019-nCoV亲缘关系最近的了。
除了对基因组整体进行比对,科学家们也将重要的开放阅读框进行了单个比对,发现新冠状病毒的棘突蛋白与SARS存在较大差异。而最新的研究表明这次的新冠状病毒很可能是通过其棘突蛋白与细胞表面受体ACE2结合而进入支气管上皮细胞和肺泡细胞的。根据对SARS病毒的研究,冠状病毒的棘突主要由S1和S2两个亚基构成,其中S1压机亚基负责与ACE2结合,而S2亚基则负责介导将病毒内吞进细胞。
病毒之所以难缠,关键就在于它们的进化极快,尤其是以单链RNA为遗传物质的病毒,由于没有DNA双螺旋的稳定性,其变异频率极高,。变异虽然大多有害,但是对于病毒这种复制速度极快的物种而言,只要有一种变异能够往适应环境的方向发展,那么这个变异的病毒就会迅速扩张壮大,令人防不胜防。

人类冠状病毒感染细胞分为7个步骤:(1)首先需要能和细胞接上头,这就要细胞表面的某个蛋白正好能和病毒表面的棘突结构相匹配,一旦匹配上,细胞便会用“保洁员”溶酶体将其“请进家门”;(2)接下来溶酶体便会按程序将其外部的脂膜和蛋白包膜溶解;(3)怎知这样正中病毒下怀,病毒正好借此将RNA释放进入细胞内,顺便利用细胞内部的翻译系统直接将自己的部分RNA转录成自己后续所需的酶;(4)在进行上一步的同时,病毒RNA也会不断利用细胞复制自己;(5)复制出来的病毒RNA会利用在第三步合成的酶在细胞的内质网上对自己的外部蛋白结构进行翻译;(6)经过上述一系列的操作,大量病毒的零件已经就位,于是组装成完整的病毒成品;(7)最后成品病毒所在的内质网与细胞膜的融合,把细胞内的病毒释放出去。释放的病毒再对其他细胞如法炮制。
目前关于2019-nCoV的感染机理研究才刚刚起步,不过由于其与其他冠状病毒结构上的类似性,其入侵过程应该与其他致病性人类冠状病毒相似。人们可以设计药物对这七个步骤进行干预,不论在哪一步阻断住病毒的进程,疾病便会得到控制。现行的抗病毒方法主要分为三类:血清/抗体疗法,疫苗疗法,化学药物疗法。
理论上说,目前有很多的痊愈患者,其自身在对抗病毒的过程中就产生了专杀2019-nCoV的抗体。那么是不是只要从他们血液中提取就行了呢?答案是否定的,血清成分复杂,危险性都很高,这是由于人产生的抗体是与自身的免疫系统相匹配的。如果强行用在其他人身上会引起排异反应造成危险;二来人类不是生物反应器,人类身体本身这种抗体存货就不多,抗体在应对过病毒后会减少,再加上提取过程中的损耗,完全不够使用;而单抗制作周期长,费用高昂,大面积用于现有病患不现实。
疫苗自不用说,天花就被我们用疫苗给干掉了,但一些善变的单链RNA病毒却没那么好对付,疫苗擅长应对相对“稳重”的DNA病毒,天花病毒就是这种太过“稳重”的DNA双链结构,难以快速发生变异而被人类消灭了。因为疫苗的原理就是注射抗原模拟病毒刺激体内免疫反应,一种疫苗只能模拟有同样抗原决定簇的病毒,如果因为突变导致这个结构不断变化,那么通过以前接种的疫苗产生的抗体或者记忆细胞将毫无用处。而且新疫苗开发周期长,无法应对目前的疫情。
所以,目前无论从时间还是现有的研究进度看,最有希望的就是药物疗法了。现在已经有了两种由吉利德公司开发的瑞德昔韦和氯喹,其中瑞德昔韦就是一种腺苷类似物,能够在病毒RNA复制的过程中整合到新链中导致RNA复制终止,抑制病毒增殖,有点类似于传统双脱氧末端终止法测序中用的双脱氧核苷酸,只不过瑞德昔韦针对的是RNA,而双脱氧核苷酸针对的是DNA。而氯喹则是一种已经广泛用于抗疟疾和自身免疫病的药物,已有体外实验表明氯喹主要在病毒进入细胞的过程中起阻碍作用。现在上述药物已经被特批进行临床实验,被寄予厚望。此外,武汉病毒所石正丽教授实验室还开发了一种广谱抗病毒肽段EK1,能够抑制包括SARS病毒和MERS病毒在内的5种冠状病毒进入细胞,而且实验是在人源化受体的小鼠中进行的,所以EK1也是潜在的药物。
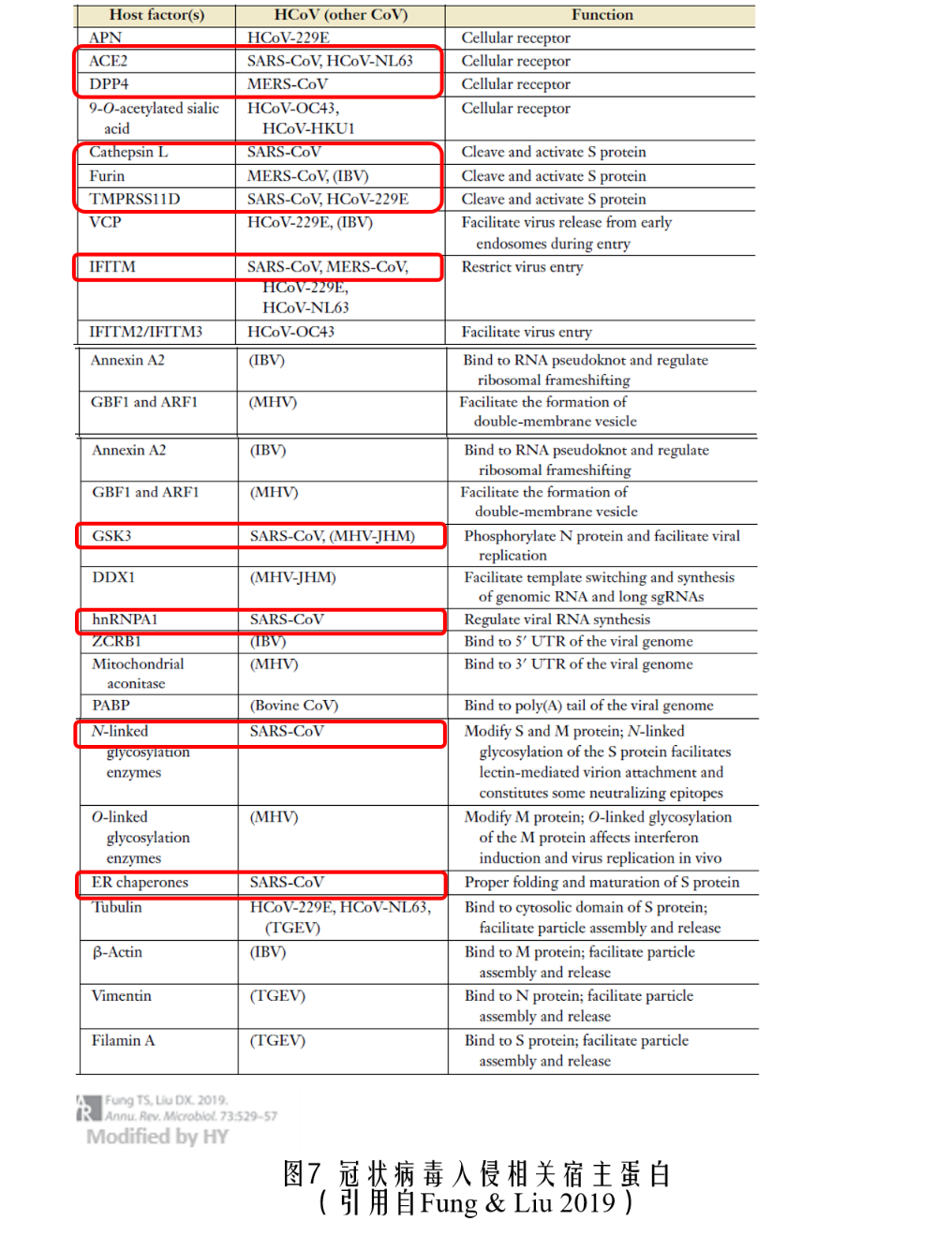
针对药物开发,最好是药物能特异性识别病毒特有的结构,而对健康宿主细胞中的正常蛋白不要产生影响。但是在不影响大局的情况下,也可以对“自己人”下手,用药物削弱与病毒勾勾搭搭的自身蛋白,达到抑制病毒扩增的目的。目前已知的冠状病毒在入侵的7个步骤中都有相应的细胞作为内应为其服务,上面的表格就总结了武汉新冠状病毒爆发前所有能感染人的冠状病毒入侵宿主是宿主内的“内奸”蛋白,其中红框标注的是和强致病病毒相关的宿主蛋白。
在这些宿主蛋白中,与新冠状病毒相关的受体ACE2同时也是SARS病毒的受体,DPP4则介导MERS的侵入;Cathepsin L、Furin和TMPRSS11D负责切割S蛋白,帮助病毒进入细胞膜;GSK3在复制过程中对核蛋白磷酸化并协助病毒复制,hnRNPA1也在病毒RNA的合成过程中发挥作用;NL-GE对翻译好的病毒棘突蛋白和膜蛋白进行糖基化修饰;ER分子伴侣负责棘突蛋白的正确折叠。上述过程中的宿主蛋白可能是新冠状病毒药物研究的靶点。不过,在新冠状病毒的入侵机理弄清楚之前,其靶点只能参考亲缘关系较近的SARS病毒,不能完全生搬硬套SARS病毒的通路,而且这些蛋白本来也是人类正常生命活动所需,因而对于其感染的基础研究也是迫在眉睫。

自然界大多数病毒都是相当专一的,一般只特异性地感染少数物种,同时很多病毒也不会导致宿主发生生命危险,但是如果不同物种间接有频繁接触,就有可能导致宿主之间的病毒遗传物质发生交换,产生对新宿主的适应性或者更加剧烈的感染性,对新的宿主产生不可预料的影响。
从这次灾难中,我们不但应当吸取教训,在没有安全保障的情况下远离野生动物,减少未知病毒入侵人体的可能。也应该加大医药研究投入,尤其是基础研究的投入,随时为奋战在一线的医疗人员提供有力的武器和充足的后勤技术保障。目前除了被动应对已经爆发的病毒疫情,我们也应该着眼于将来对病毒的预防。
现在随着深度学习和人工智能的快速发展,如果能够利用这些技术手段,加上现有研究积累的大量病毒基因组数据以及突变数据,对病毒序列加以分析,对病毒变异有可能产生的宿主迁移进行概率预测,并对其棘突蛋白等关键结构的三维构象进行精准构建,提前进行药物设计,那么就会使我们面对病毒时更加主动,料敌于先,把病毒对人类造成的伤害降到最低,甚至将病毒疫情的爆发扼杀在摇篮之中。
参考文献:
1. To Sing Fung and Ding Xiang Liu. Human Coronavirus: Host-Pathogen Interaction. Annual Review of Microbiology. Vol. 73, (2019)
2. Zhou, P. et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature https://doi.org/10.1038/s41586-020-2012-7, (2020).
3. Wu, F. et al. A new coronavirus associated with human respiratory disease in China. Nature https://doi. org/10.1038/s41586-020-2008-3, (2020).
4. Jie Cui et al. Origin and evolution of pathogenic coronaviiruses. Nature reviews. (2019)
5. Shibo Jiang et at. An emerging coronavirus causing pneumonia outbreak in Wuhan, China: calling for developing therapeutic and prophylactic strategies. Emerging microbes&infections. (2020)
6. Chan et at. A familial cluster of pneumoniaassociated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster,The Lancet, (2020)
